中国电子烟品牌又被FDA点名了?
事情发展在7月27日,FDA发布新闻稿,称已向三家分销商——ABS Distribution Inc.,EC Supply, Inc.以及Easy Wholesale, LLC发出警告信。理由是上述公司销售和/或分销了多种未通过PMTA的电子烟产品,包括Elf Bar/EB Design,Esco Bars和PUFF Max。
进入2023年以来,FDA频频发布各种进口警报、警告信等,对象也从企业进一步扩大到了分销商和零售商。尽管此次被发警告信的是美国的分销商,格物消费也第一时间向ELFBAR/EB Design的生产企业爱奇迹进行了求证,相关负责人向我们给出针对此事的回复:
“IMiracle is aware of the U.S. Food and Drug Administration(FDA) action announced on July27, 2023. IMiracle understands that our U.S. distributors of vaping products believe in providing responsibly manufactured and high-quality products to retail customers while complying with the law. In the meantime, IMiracle remains committed to supporting its distribution partners, and to working with the agency to achieve an resolution to these issues and to the its business partners.“
“爱奇迹已了解到FDA 7月27日采取的行动。爱奇迹了解,我们美国电子烟分销商在遵循法律的同时,坚持提供负责任生产的、高品质的产品给零售客户。与此同时,爱奇迹始终支持我们的分销合作伙伴和商业合作伙伴,并与监管机构合作致力解决这些问题。“
此次警告信的对象究竟是谁?这一警告与此前“出口指引”提到的内容是有有关?
此次警告信究竟针对谁?
此事之所以引起不少从业者关注,原因之一才发布的“电子烟出口指引”就提到了在海外被通报后应该如何处理。而看完以上由格物消费梳理的此次事件的背景,可以得出以下几个结论:
其一,警告的对象并不是中国电子烟企业。FDA官网写得明明明白,被警告的是三家美国的电子烟分销商。而他们被警告的原因,是销售未通过PMTA的产品,并不特指中国企业。
其二,此次警告并不涉及产品品质问题。尽管提到了来自中国的电子烟品牌,但FDA的表述并不涉及任何与产品质量安全问题相关的内容,而是手续和程序的问题。一个典型的例子是7月10日FDA才向帝国烟草的电子烟品牌myblu发了营销禁令(MDO),原因依然是没拿到PMTA。

其三,此次警告信并不特殊。FDA依然按照惯例,为警告对象提供了15个工作日来说明如何解决以及预防违规;如何没能说清楚情况,才是后续禁令、查封和/或民事罚款。
同时,FDA强调此次警告信是为禁止未通过PMTA产品在美销售,而对供应链进行一系列努力的最新成果——换言之,警告力度没变,依然是按部就班的工作。
显然,FDA的此次动作既在情理之中,也在意料之内。基于FDA于今年2月放出的消息,预计要在今年12月31日前才能完成所有PMTA申请的审查,而截止目前,PMTA申请通过的SKU依然只有仅仅23个,按照这一进度,持续发布警告信依然是FDA未来一段时间的日常。
FDA为什么发布警告信?
那么,FDA为什么会发布上述警告信?要综合FDA目前的状态以及手上的武器来看。
第一,FDA侧重流通端执法;
在此前格物消费的推文《对话郑植:PMTA下半年进入关键期,美国市场将迎来大变局》中我们曾总结,过去两年FDA经历了大量人事变动以及工作流程的调整,直到今年3月27日烟草产品中心科学审查办公室新一任主任就职,FDA才算是把自己的烂摊子理顺了。
带来的影响是什么呢?FDA执法变得更有章法:不再只是给电子烟企业发警告,而是有能力将执法对象从制造企业,扩大到分销商、零售商了。比如格物5月31日推文《FDA打响“闪电战”狠抓一次性,市场第一puff BAR与第三Hyde被警告》就提到,FDA已经对零售商动手了。
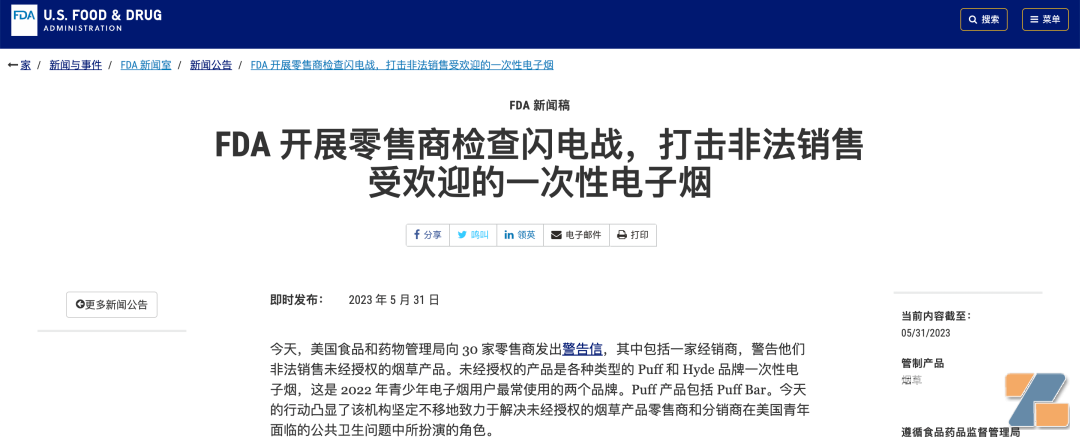
结合此次发给分销商的警告信不难看出,当下FDA的工作重点主要就在流通端、市场端。那么自然而然,在美国市场销量更大的品牌最容易进入FDA的视野范围内。抓大放小,人之常情。
第二,FDA的监控能力加强;
FDA新闻稿最后一段有这么一句话:FDA和国家卫生研究所上月宣布,已经为快速烟草监测中心(CRST)提供了资金。该中心将通过提供更多关于烟草产品市场变化和烟草使用模式的快速信息,来补充CTP的内部监控工作。
关于这个快速烟草监测中心,格物消费也曾在《非PMTA产品窗口期缩短,FDA快速监测中心启动,实时监控市场动态》中进行介绍:其于6月1日开始运营,监控数据主要包括:品牌营销动作、零售商销售数据、消费人群行为等(如下图):

多位深耕美国市场的从业者曾向我们表示,“FDA就是一帮科学家,对于电子烟市场的理解并不深。这就导致,无论是PMTA申请流程也好,还是审核标准都过于保守甚至低效。CRST的启动,FDA在选择执法对象方面,显然会进一步贴近市场动态。
面对此类警告信,制造商如何应对?
当下的美国电子烟市场实际上有一个“根本矛盾”:海量的市场主流在售产品PMTA审核尚未完成,和FDA被美国立法者、社会舆论要求将非PMTA产品清除出市场的矛盾。
本质上来说,警告也好、警告信也好,其中也有向外界“交差”的成分。以及通过不断的动作博得更多的执法授权,或是资金支持,上文提到的CRST就是成果之一。
实际上更值得注意的是,由于美国存在州法和联邦法两个层级,加之执行力度亦有所不同。分销商、零售商被点名这件事,也并不完全在制造商的可控范围之内。
根源在于,和国内电子烟市场以经销商形式为主不同,欧美市场起步早,早已形成成熟的批发商(分销商)模式,一手交钱一手交货,钱货两清之后,货物的流向实际上难以由制造商把控。
所以,此次警告信事件,对于制造商而言更像是一次提醒。
以现阶段FDA的执法更侧重于从分销商、零售商来看,制造商有必要提前做好准备。比如,尝试在分销合同上提出一些限制、划分责任,再次遇到此类双方如何进行协作。其次,在美国市场投入更多人力对于分销商的经营进行跟踪,提前规避被发警告信。
综上而言,除了再次佐证PMTA即将在今年年底“真正执行”之外,此次事件更多反映出对于电子烟制造商而言,除了做好把控产品质量安全的本职工作,更需要投入更多精力关注FDA的动向,适时调整美国市场的经营方式,尽可能在满足合规要求的同时减少损失。