7月31日消息,据外电报道,美国食品和药物管理局 (FDA)根据法院命令,需要在 2021 年 9 月 9 日前审查并授权或拒绝授权销售制造商提交的上市前烟草申请 (PMTA) 的新烟草产品。但由于有大量申请等待审查,FDA 不太可能在最后期限前完成。
背景
按照《烟草控制法》的联邦法律要求,在将烟草产品引入美国市场之前,新产品必须经过 FDA 的上市前审查并获得该机构的营销授权。
如果产品在 2007 年 2 月 15 日之前已经上市,则该产品不受限制,不需要上市前申请,也不需要 FDA 授权。
对于 2007 年 2 月 15 日之后进入市场的每一种烟草产品,都需要申请。
将新烟草产品与具有祖父或已经获得 FDA 批准令的类似烟草产品进行比较的实质等效 (SE) 申请,或者与祖父不相似的新烟草产品需要 PMTA 申请产品并于 2007 年 2 月 15 日之后推向市场。向 FDA 提交这些申请的截止日期为 2020 年 9 月 9 日。一旦制造商向 FDA 提交 SE 或 PMTA,该机构将进行四步审查过程。
首先,FDA 对申请进行初步审查,看看是否一切都完整。接下来,如果所有科学研究、证据和其他数据随申请一起提交,该机构就会提交申请。第三,FDA 对申请进行实质性审查,最长可能需要一年或到 2021 年 9 月 9 日的截止日期。第四,FDA 发布授权或不授权申请的命令。为了授权申请,FDA 需要确定该产品“适合保护公众健康”。
FDA 进展
6 月 11 日,FDA 科学办公室举办了一场名为认定产品审查:与烟草产品科学办公室中心的对话”的现场网络研讨会。网络研讨会的目的是提供有关该机构对视为产品的上市前烟草应用的科学审查的最新信息和信息,这些产品包括雪茄、烟斗烟草、水烟烟草和电子烟/尼古丁蒸气产品。网络研讨会的主要重点是申请受理流程、申请审查进度和机构审查资源的分配。
由于 FDA 要求在 2021 年 9 月 9 日之前完成对所有 PMTA 的审查,并且考虑到提交的大量申请,科学办公室表示,它正在努力在这一年期间审查尽可能多的申请法院命令中所述,该命令设定了(2020 年 9 月 9 日)申请截止日期,并且 FDA 拥有酌情决定推迟对特定产品采取强制措施的权利。
根据 FDA 网站,在 2019 年 10 月至 2020 年 7 月期间提交了 269 份 PMTA。然后,在 2020 年 8 月,也就是 2020 年 9 月 9 日提交截止日期前一个月,提交了大约 10,184 份 PMTA。去年 9 月的前 9 天,又提交了 4,567 份 PMTA。这意味着近 15,000 份 PMTA 已经提交并正在等待该机构处理。
FDA 现在公布了一份已提交和接受的 PMTA 清单,以便行业成员了解哪些产品已提交申请。
完整的 PMTA 指标集可在此处获得。
FDA 工作人员还表示,FDA 审查 2021 年 9 月 9 日之前收到的所有申请的可能性极低。
这意味着,如果申请审查程序在 2021 年 9 月 9 日之前尚未结束,FDA 可以决定不对制造商采取强制措施,根据具体情况延长审查 PMTA 申请的时间。谁及时提交了 PMTA。
下图来自 FDA 网站,该网站报告称,在四步申请审查过程的接受阶段,涵盖按类别列出的产品数量的申请已被该机构接受:
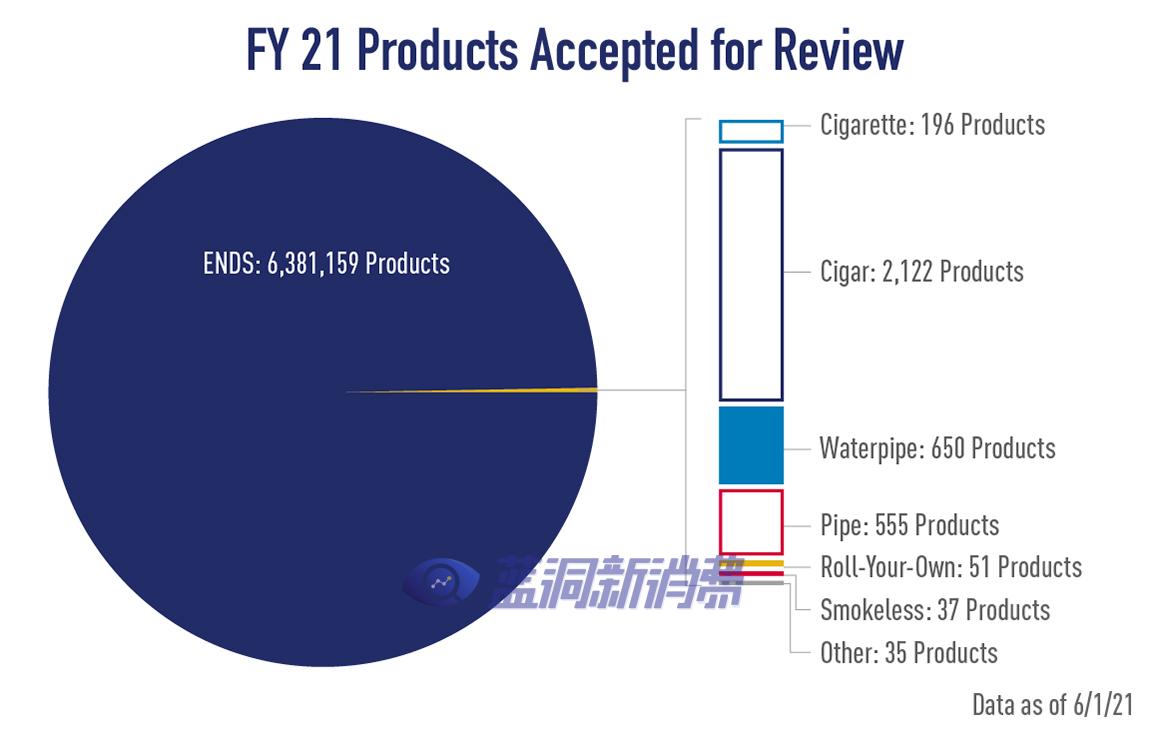
此外,FDA 在其网站上报告称,已向制造商发出拒绝接受信函,申请涵盖 59,229 种电子尼古丁传递系统 (ENDS) 产品(即电子烟/蒸气产品)、5 种雪茄产品和 25 种其他类型的产品。
此外,FDA 网站显示,该机构向制造商发出了拒绝提交信函,申请涵盖 3,628 种 ENDS 产品,因为申请中没有包含必要的信息。
最后,已向制造商发送了涵盖 138,377 种 ENDS 产品的申请的备案信函,通知制造商他们的申请将进入审查过程的第三阶段或实质性审查阶段。如果没有为产品提交 SE 或 PMTA 申请,并且需要在 2020 年 9 月 9 日之前提交申请,则该产品在市场上是非法的,必须从市场上移除。
FDA 继续处理大量提交的申请;但是,该机构不太可能在 2021 年 9 月 9 日的截止日期之前审查所有 15,000 多份申请。但是,该机构可以酌情根据具体情况延长审查时间,并选择不采取任何执法行动。
行业成员应定期查看 FDA 网站,了解有关 PMTA 申请状态的更多信息。









